Содержание:
- Введение…………………………………………………………..........3
- Определение витамина В1 (обзор литературы)
2.1. Историческая справка………………………………………………...4
2.2. Классификация витаминов…………………………………………...6
2.3. Строение и свойства витамина В1……………………………………7
2.4. Синтез витамина В1…………………………………………………...8
2.5. Распространение в природе и применение……………………….....8
3. Методы определения витаминов……………………………………….9
3.1. Биологические методы………………………………………………..9
3.2. Химические методы………………………………………………….10
3.3. Физические методы……………………………………………...…..10
3.4. Физико-химические методы………………………………………...11
III. Аналитическое определение витамина В1 (экспериментальная часть) ……………………………………………………………………...14
- Потенциометрическое определение витамина В1…………….14
- Аргентометрическое определение витамина В1……………....18
IV. Заключение…………………………………………………………....23
V. Список используемой литературы……………………………………24
- Введение:
В настоящее время на рынке появилось огромное количество витаминизированных продуктов питания для человека и кормов для животных, представляющих собой сухие многокомпонентные смеси. Ассортимент таких продуктов представлен достаточно широко. Это, прежде всего, биологически активные добавки к пище, комбикорма для животных и птиц, поливитаминные препараты. Критерием качества таких продуктов может являться их анализ на содержание витаминов и, особенно, таких жизненно необходимых, как водорастворимые и жирорастворимые витамины, количество которых регламентируется нормативными документами и санитарными нормами качества.
Витамины принадлежат к различным классам органических соединений. Поэтому для них не могут существовать общие групповые реакции; каждый из витаминов требует особого аналитического подхода.
Химическая структура витамина В1 (антиневритический витамин, аневрин, бери-бери витамин, анти-бери-бери витамин), позволяет применить различные методы химического и физико-химического количественного определения:
кислотно-основное титрование, осадительное титрование (аргентометрия), физико-химические методики (спектрофотометрические), гравиметрия.
Целью данной курсовой работы, является количественное определение витамина В1. Было выбрано два способа количественного определения- химический и физико-химический методы.
Задачи курсовой работы: Произвести анализ литературы, выполнить два количественных определения тиамина- потенциометрическим титрованием и аргентометрическим методом.
II. Определение витамина В1 (обзор литературы)
- Историческая справка.
Всем известное слово "витамин" происходит от латинского "vita" - жизнь. Такое название эти разнообразные органические соединения получили далеко не случайно: роль витаминов в жизнедеятельности организма чрезвычайно велика.
Витамины представляют собой группу разнообразных по строению химических веществ, принимающие участие во многих реакциях клеточного метаболизма. Они не являются структурными компонентами живой материи и не используются в качестве источников энергии. Большинство витаминов не синтезируются в организме человека и животных, но некоторые синтезируются микрофлорой кишечника и тканями в минимальных количествах, поэтому основным источником этих веществ является пища.
Ко второй половине XIX века было выявлено, что пищевая ценность продуктов питания определяется содержанием в них в основном следующих веществ: белков, жиров, углеводов, минеральных солей и воды.
Однако практика далеко не всегда подтверждала правильность укоренившихся представлений о биологической полноценности пищи.
Экспериментальное обоснование и научно-теоретическое обобщение этого многовекового практического опыта впервые стали возможны благодаря исследованиям русского ученого Николая Ивановича Лунина.
Он провел эксперимент с мышами, разделив их на 2 группы. Одну группу он кормил натуральным цельным молоком, а другую держал на искусственной диете, состоящей из белка-казеина, сахара, жира, минеральный солей и воды.
Через 3 месяца мыши второй группы погибли, а первой остались здоровыми. Этот опыт показал, что помимо питательных веществ, для нормальной жизнедеятельности организма, необходимы еще какие-то компоненты.
Это было важное научное открытие, опровергавшее установившееся положения в науке о питании.
Блестящим подтверждением правильности вывода Н. И. Лунина установлением причины болезни бери-бери.
В 1896 году английский врач Эйкман заметил, что куры, питавшиеся полированным рисом, страдали нервным заболеванием, напоминавшим бери-бери у людей. После дачи курам неочищенного риса заболевание прекратилось. Он сделал вывод, что витамин содержится в оболочке зерен. В 1911 году польский ученый Казимир Функ выделил витамин в кристаллическом виде. Окончательное строение витамина В1 было установлено в 1973 году.
По своим химическим свойствам это вещество принадлежало к органическим соединениям и содержало аминогруппу. Функ, полагая, что во всех подобных веществах обязательно должны входить аминные группировки, предложил называть эти неизвестные вещества витаминами, т.е. аминами жизни. В дальнейшем было установлено, что многие из них аминных групп не содержат, но термин «витамин» прижился в науке и практике[1].
Согласно классическому определению, витамины - это необходимые для нормальной жизнедеятельности низкомолекулярные органические вещества, которые не синтезируются организмом данного вида или синтезируются в количестве, недостаточном для обеспечения жизнедеятельности организма. Витамины необходимы для нормального протекания практически всех биохимических процессов в нашем организме.
- Классификация витаминов:
Современная классификация витаминов не является совершенной. Она основана на физико-химических свойствах (в частности, растворимости) или на химической природе. В зависимости от растворимости в неполярных органических растворителях или в водной среде различают жирорастворимые и водорастворимые витамины. В приводимой классификации витаминов, помимо буквенного обозначения, в скобках указан основной биологический эффект, иногда с приставкой «анти», указывающей на способность данного витамина предотвращать или устранять развитие соответствующего заболевания.
Витамины, растворимые в жирах
1. Витамин Л (антиксерофгальмический); ретинол
2. Витамин D (антирахитический); кальциферолы
3. Витамин Е (антистерильный, витамин размножения); токоферолы
4. Витамин К (антигеморрагический); нафтохиноны
Витамины, растворимые в воде
- Витамин В1 (антиневритный); тиамин
- Витамин В2 (витамин роста); рибофлавин
- Витамин В6 (антидерматитный, адермин); пиридоксин
- Витамин В12 (антианемический); цианкобаламии; кобаламин
- Витамин РР (антипеллагрический, ниацин); никотинамид
- Витамин Н (антисеборейный, фактор роста бактерий, дрожжей и грибков); биотин
- Витамин С (антискорбутный): аскорбиновая кислота
- Строение и свойства витамина В1

Витамин В1-тиамин является хлористоводородной солью 4-метил-5-β-оксиэтил- N - (2-метил-4-амино-5-метилпиримидил) -тиазолийхлорида, получается синтетически обычно в виде хлористо-или бромистоводородной соли[2]. В его структуру входят такие гетероциклические системы, как пиримидил и тиазол.
Витамин В1- белый кристаллический порошок горь¬кого вкуса, с характерным запахом, хорошо рас¬творяется в воде(1г в 1 мг), ледяной уксусной кислоте, в этиловом спирте. В сильнокислой водной среде тиамин обладает высокой устойчивостью и не разрушается под действием таких энергичных окислителей, как перекись водорода, марганцовокислый калий и озон. При рН=3,5 тиамин может нагреваться до температуры 120ºС без заметных признаков разложения[1].
Витамин В1 способен окисляться. В щелочной среде под действием красной кравяной соли тиамин переходит в тиохром. Превращение тиамина в тиохром количественный необратимый процесс.
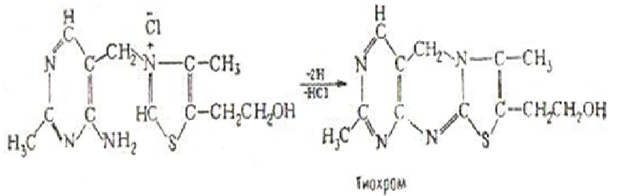
Эта реакция положена в основу одного из количественных методов определения витамина В1[1]. Превращение тиамина в тиохром сопровождается утратой витаминной способности.
- Синтез
Учитывая особенности строения витамина В1, его синтез может быть осуществлен тремя путями: конденсацией пиримидинового и тиазольного компонентов, на основе пиримидинового компонента и на основе тиазольного компонента.
Рассмотрим первый вариант. Оба компонента синтезируются параллельно, а затем соединяются в молекулу тиамина. Конкретно 2- метил-4-амино-5 хлорметилпиримидин взаимодействует с 4-метил-5-оксиэтиазолом, образуя четвертичную тиазолевую соль:

Конденсация проходит при температуре 1200С в толуоле или бутиловом спирте. Далее полученный тиамин выделяют из реакционной смеси осаждением ацетоном и очищают перекристаллизацией из метанола[1].
- Распространение в природе и применение
Тиамин распространен повсеместно и обнаруживается у разных пред-ставителей живой природы. Как правило, количество его в растениях и микроорганизмах достигает величин значительно более высоких, чем у животных. Кроме того, в первом случае витамин представлен преимущественно свободной, а во втором — фосфорилированной формой. Содержание тиамина в основных продуктах питания колеблется в довольно широких пределах в зависимости от места и способа получения исходного сырья, характера технологической обработки полупродуктов и т. п.
В злаковых семенах растений тиамин, подобно большинству водорастворимых витаминов, содержится в оболочке и зародыше. Переработка растительного сырья (удаление отрубей) всегда сопровождается резким снижением уровня витамина в полученном продукте. Шлифованный рис, например, совсем не содержит витамина.
Витамин В1 широко применяется в медицинской практике для лечения различных нервных заболеваний (неврозов, полиневритов), сердечно - сосудистых расстройств(гипертония) и др.
Витаминизация хлебобулочных изделий и комбикормов в животноводстве и птицеводстве[1].
Суточная потребность взрослого человека в среднем составляет 2-3 мг витамина В1. Но потребность в нём в очень большой степени зависит от состава и общей калорийности пищи, интенсивности обмена веществ и интенсивности работы. Преобладание углеводов в пище повышает потребность организма в витамине; жиры, наоборот, резко уменьшают эту потребность.
- Методы определения витаминов
Все методы исследования витаминов подразделяются на биологические (микробиологические), физические, химические и физико-химические.
- Биологические методы
Несмотря на то, что биологические методы определения некоторых витаминов отличаются высокой чувствительностью и могут использоваться для исследования образцов с незначительным содержанием этих соединений, в настоящее время они представляют главным образом исторический интерес. Точность этих методов невысока, кроме того биологические методы требуют больших затрат времени и средств и неудобны для проведения серийных анализов.
Микробиологические методы основаны на измерении скорости роста бактерий, которая пропорциональна концентрации витамина в исследуемом объекте.
- Химические методы
Специфичность свойств витаминов обусловлена наличием в их молекулах функциональных групп. Это свойство широко используется при количественном и качественном химическом анализе.
Химические методы анализа:
1) Фотометрический;
2) Титриметрический(заключается в том, что все вещества реагируют между собой в эквивалентных количествах С![]() *V
*V![]() = С
= С![]() *V
*V![]() [3]);
[3]);
3) Гравиметрический(заключается в выделении вещества в чистом виде и его взвешивании. Чаще всего такое выделение проводят осаждением. Реже определяемый компонент выделяют в виде летучего соединения(метод отгонки). Аналитический сигнал-масса[3]);
4) Оптический(основан на поглощении системой некоторого количества лучистой энергии атомами. Количество энергии поглощения находится в прямой зависимости от концентрации вещества в растворе[3]).
- Физические методы
Применение физических методов в анализе витаминов (например, ПМР) ограничено высокой стоимостью приборов.
1. Кондуктометрический - основан на измерении электропроводности раствора[3].
2. Потенциометрический(в основе метода лежит измерение зависимости равновесного потенциала электрода от активности(концентрации) определяемого иона определяемого иона. Для измерений необходимо сравнивать элемент из подходящего индикаторного электрода и электрода сравнения[3]).
3. Масс-спектральный - применяется при помощи сильных элементов и магнитных полей, происходит разделение газовых смесей на компоненты в соответствии с атомами или молекулярными массами компонентов. Применяется при исследовании смеси изотопов, инертных газов, смесей органических веществ.
3.4. Физико-химические методы
В настоящее время в практике фармацевтического анализа находят все большее применение физико-химические методы анализа, как наиболее точные и экспрессные по своему исполнению. К ним относятся оптические, электрохимические и хроматографические методы анализа.
Среди оптических методов наибольшее распространение получили спектрофотометрические и фотоколориметрические методы, основанные на общем принципе - существовании в известных границах концентраций прямой пропорциональной зависимости между светопоглощением раствора и концентрацией растворенного вещества. Спектрофотометрический анализ по непосредственному измерению оптической плотности может быть проведен для веществ, обладающими определенными особенностями строения – в структуре должны быть хромофорные и ауксохромные группы (например, гетероатомы, системы сопряженных связей).
К достоинствам колориметрических (фотометрических) методов можно отнести доступность оборудования и средств измерения, экспрессность. Основным недостатком является низкая селективность, препятствующая применению этих методов к сложным по составу объектам. Сказывается влияние сопутствующих компонентов: провитаминов, антиоксидантов, производных витаминов, продуктов деструкции витаминов, способных подобно витаминам, давать окрашенные продукты. Встречаются трудности при подборе специфического реактива для взаимодействия с определенным витамином.
Несмотря на недостатки этого метода, для многих витаминов разработаны методики фотометрического определения.
Несмотря на разнообразие методик фотометрического определения витаминов ученые до сих пор интересуются этим методом, унифицируют старые методики и создают новые.
Хроматографические методы анализа очень распространены в фармацевтической практике. Эти методы перспективны при анализе веществ, содержащих витамины и имеющих сложную структуру.
Вплоть до относительно недавнего времени наиболее часто из хроматографических методов использовали газожидкостную хроматографию (ГЖХ).
В настоящее время альтернативным способом быстрого определения витаминов в разнообразных объектах является высокоэффективная жидкостная хроматография (ВЭЖХ).
Определение витаминов методом высокоэффективной жидкостной хроматографии не требует длительной пробоподготовки, достаточно высока чувствительность метода, однако высокая стоимость оборудования существенно ограничивает применение этого метода.
Электрохимические методы анализа основаны на использовании ионообменных или электрообменных процессов, протекающих на поверхности электрода или в при электродном пространстве. Аналитическим сигналом служит любой электрический параметр (потенциал, сила тока, сопротивление, электропроводность и т.д.), функционально связанный с составом и концентрацией раствора.
Электрохимические методы анализа играют важную роль в современной фармацее, поскольку характеризуются высокой чувствительностью, низкими пределами обнаружения, широким интервалом определяемых содержаний. Самыми распространенными методами являются полярография и вольтамперометрия. Литературные данные по полярографическому исследованию витаминов самые многочисленные. Полярографически можно определять количественное содержание каждого витамина в индивидуальных и в сложных фармацевтических препаратах.
Метод достаточно чувствительный, но использование полярографии ограничено применением токсичного ртутного электрода.
Вместе с тем метод потенциометрического титрования является экспрессным, простым в выполнении, не требует дорогостоящего оборудования и реактивов.
III. Экспериментальная часть
1.Потенциометрическое определение витамина В1[5]
В структуру витамина В1 входит подвижный хлор (С12Н18ОN4Cl2S):
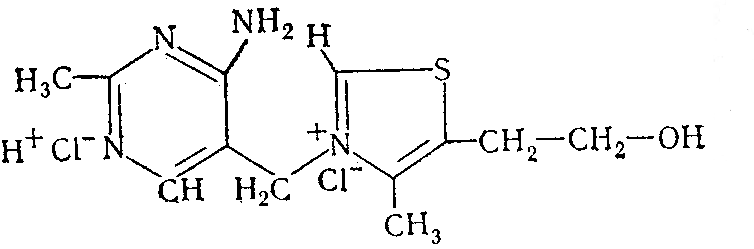
Это дало возможность использовать осадительное потенциометрическое титрование для определения тиамина. В качестве индикаторного электрода использовался серебряный электрод. Титрантом служил раствор нитрата серебра с концентрацией 0,05 моль/л.
Для проведения анализа готовили растворы с концентрацией витамина В1 0,02968моль/л. Для этого содержимое 10 ампул количественно переносили в колбу на 50 мл и доводили до метки дистиллированной водой. Объем ампул равен 1 мл, содержание витамина В1 - 50 мг(Производитель: ОАО «Мосхимфармпрепараты» им. Н.А.Семашко). Отбирали аликвоты, объемом по 5 мл и проводили потенциометрическое титрование. Эквивалентный объем раствора нитрата серебра при титровании 5 мл раствора витамина 6 мл. Было выполнено 8 потенциометрических измерений.
Примеры кривых титрования представлены на рисунках 1, 2, 3, 4, 5. Кривые титрования построены в координатах- интегральные кривые V, мл- Е, Вт, а дифференциальные кривые в координатах – ΔV - ![]()

Рис.1 Кривая потенциометрического титрования витамина В1(Val=5 мл)

Рис.2 Кривая потенциометрического титрования витамина В1(Val=5 мл)
Рис.3 Кривая потенциометрического титрования витамина В1(Val=5 мл)

Рис.4 Кривая потенциометрического титрования витамина В1(Val=5 мл)
Рис.5 Кривая потенциометрического титрования витамина В1(Val=5 мл)
Содержание витамина В1 в аликвоте:
![]()
где ТAgNO3/вит.В1.= (0,05*337)/1000=0,01685г/мл; Vэ- объем нитрата серебра, пошедший на титрование.
Содержание витамина В1 в одной таблетке::
 ,
,
где Vколбы = 50мл, ТAgNO3/вит.В1 = 0,008425г/мл, Vэ – объем нитрата серебра, пошедший на титрование, Val = 5 мл, N - число ампул (10 шт).
Результаты анализа представлены в таблице 1.
Таблица 1. Результаты анализа потенциометрического титрования.
№ |
V, мл |
а, мг |
m, г |
1 |
6 |
0.1011 |
0,05055 |
2 |
6 |
0.1011 |
0,05055 |
3 |
6,5 |
0,1095 |
0,05476 |
4 |
6 |
0.1011 |
0,05055 |
5 |
6 |
0.1011 |
0,05055 |
6 |
6 |
0.1011 |
0,05055 |
7 |
6 |
0.1011 |
0,05055 |
8 |
6 |
0.1011 |
0,05055 |
<среднее> |
6,0625 |
0,10215 |
0,051076 |
Приведённые результаты свидетельствуют о наличии выпадающих результатов. Определение промахов ведем по Q-критерию: Тестовая статистика Q-критерия вычисляется по формуле:
![]()
где x - "подозрительное" значение (вероятный промах) - это максимальное или минимальное значение выборки, xближайшее - ближайшее к подозрительному значение, xmin и xmax - максимальное и минимальное значения выборки. Значение Q сравнивают с табличным значением(Таблица 2). Доверительную вероятность берут равной 0.90 или 0.95. Если Q> Qтабл - подозрительный результат является промахом и исключается из дальнейшего рассмотрения; Q< Qтабл - подозрительный результат не является промахом.
Таблица 2. Критические значения Q-критерия для различной доверительной вероятности p и числа измерений n.
n |
p |
||
0.90 |
0.95 |
0.99 |
|
3 |
0.941 |
0.970 |
0.994 |
4 |
0.765 |
0.829 |
0.926 |
5 |
0.642 |
0.710 |
0.821 |
6 |
0.560 |
0.625 |
0.740 |
7 |
0.507 |
0.568 |
0.680 |
8 |
0.468 |
0.526 |
0.634 |
9 |
0.437 |
0.493 |
0.598 |
10 |
0.412 |
0.466 |
0.568 |
Вычисления: n=8; р=0.90;
Q=  =1,0>0,468
=1,0>0,468
Q-критерий свидетельствует, что результат является промахом, и мы его не учитываем.
Исключая промах получаем m= 0,05055 г, по нормативным документам содержание витамина В1 должно быть равным 0,05 г.
Погрешность составляет:
ΔХ= 0,05055-0,05= 0,00055 г
Δ=  = 1,1%
= 1,1%
Математическая обработка результатов КХА
(количественного химического анализа)
- Среднее квадратичное отклонение, характеризующее разброс результатов КХА:
Таблица 3. Вспомогательная таблица для расчета СКО.
mi |
|
mi - |
(mi - |
S |
0,05055 |
0,05055 |
0 |
0 |
0 |
0,05055 |
0,05055 |
0 |
0 |
0 |
0,05055 |
0,05055 |
0 |
0 |
0 |
0,05055 |
0,05055 |
0 |
0 |
0 |
0,05055 |
0,05055 |
0 |
0 |
0 |
0,05055 |
0,05055 |
0 |
0 |
0 |
0,05055 |
0,05055 |
0 |
0 |
0 |
 ;
; 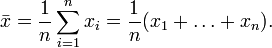
- Доверительный интервал:
Верхнюю и нижнюю границы интервала, в котором погрешность результатов КХА находится с доверительной вероятностью 0,95, определяли следующим образом:
![]()
![]() 0,05055
0,05055
- Аргентометрическое определение витамина В1
Аргентометрическое определение по методу Фаянса[6],[7]. Метод Фаянса – это метод прямого титрования галогенидов раствором AgNO3
0,1М в слабо кислой среде с применением адсорбционных индикаторов, которые
показывают изменение цвета не в растворах, а на поверхности выпавшего
осадка.
Использовали раствор, приготовленный для первого метода количественного определения тиамина с концентрацией витамина 0,02968моль/л. Val= 5 мл. Прибавляли 2-3 капли раствора бромфенолового синего и по каплям разведенную уксусную кислоту до получения зеленовато-желтого окрашивания. Полученный раствор титровали 0,1 М раствором нитрата серебра до фиолетовой окраски.
Титрование идет по уравнению:
(С12Н17N4ОS)Cl- .HCl +2AgNO3= 2AgCl + (С12Н17N4ОS)NO3- .HNO3
Расчеты:
Таблица 4. Результаты аргентометирического определения витамина В1
№ |
V |
m, г |
1 |
1,5 |
0,05055 |
2 |
1,5 |
0,05055 |
3 |
1,5 |
0,05055 |
4 |
1,5 |
0,05055 |
5 |
1,4 |
0,04718 |
6 |
1,5 |
0,05055 |
7 |
1,5 |
0,05055 |
8 |
1,5 |
0,05055 |
9 |
1,4 |
0,04718 |
10 |
1,5 |
0,05055 |
<среднее> |
1,48 |
0,04988 |
Приведённые результаты свидетельствуют о наличии выпадающих результатов. Определение промахов ведем по Q-критерию: Тестовая статистика Q-критерия вычисляется по формуле:
![]()
Вычисления: n=10; р=0.90;
 > 0,412
> 0,412
Q-критерий свидетельствует, что результат является промахом, и мы его не учитываем в дальнейших расчетах.
- Установление титра AgNO3 0,1 N по раствору NaCl 0,1 N
![]() =
= ![]() ;V-объем AgNO3, пошедший на титрование, мл.
;V-объем AgNO3, пошедший на титрование, мл.


 = 0,05055г
= 0,05055г- Погрешность составляет:
ΔХ= 0,05055 -0,05= 0,00055 г
Δ= ![]() = 1,1%
= 1,1%
Математическая обработка результатов КХА
(количественного химического анализа)
- Среднее квадратичное отклонение, характеризующее разброс результатов КХА
Таблица 5. Вспомогательная таблица для расчета СКО.
mi |
|
mi - |
(mi - |
S |
0,05055 |
0,05055 |
0 |
0 |
0 |
0,05055 |
0,05055 |
0 |
0 |
0 |
0,05055 |
0,05055 |
0 |
0 |
0 |
0,05055 |
0,05055 |
0 |
0 |
0 |
0,05055 |
0,05055 |
0 |
0 |
0 |
0,05055 |
0,05055 |
0 |
0 |
0 |
0,05055 |
0,05055 |
0 |
0 |
0 |
0,05055 |
0,05055 |
0 |
0 |
0 |
 ;
; 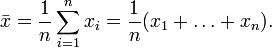
- Доверительный интервал:
Верхнюю и нижнюю границы интервала, в котором погрешность результатов КХА находится с доверительной вероятностью 0,95, определяли следующим образом:
![]()
![]() 0,05055
0,05055
IV. Заключение
В данной курсовой работе стояла задача количественно определить витамин В1. Для определения витаминов применяют различные методы. Так же необходимо учитывать химическое строение каждого витамина. Широко используемые оптические методы анализа трудоемки, требуют больших затрат времени и дорогостоящих реактивов, применение хроматографических методов осложнено использованием дорогостоящего оборудования. Было выбрано два метода определения тиамина:
- Потенциометрическое титрование, который имеет ряд преимуществ по сравнению с существующими методами анализа фармпрепаратов, на содержание в них витаминов: метод прост, экспрессен, не требует дорогостоящего оборудования, расход реактивов минимален, исключено влияние субъективных факторов.
По этому методу ошибка составляет 1,1%.
S = 0
Доверительный интервал: ![]() 0,05055.
0,05055.
- Титрование, заключается в том, что все вещества реагируют между собой в эквивалентных количествах С
 *V
*V = С
= С *V
*V
В данном методе определения тиамина ошибка составляет 1,1%.
S = 0
Доверительный интервал: ![]() 0,05055.
0,05055.
V. Список используемой литературы
1. Биохимия: учеб.для вузов 3-е изд., стереотип. / В.П. Комов; В.Н. Шведова М.: Дрофа, 2008. -638 с.
2. Химия витаминов/ В.М. Березовский М.: «Пищевая промышленность», 1973. -632 с.
3. Основы аналитической химии книга 2 методы химического анализа / Ю.А. Золотов «Высшая школа» год; 2002. -494 с.
4. Аналитическая химия, учебное пособие/ Н.Я. Логинов; А.Г.Воскресенский; И.С. Солодкин-. М.: «Просвещение» 1975.- 478 с.
5. Михеева Е.В. Вольтамперометрическое определение водорастворимых витаминов В1 и В2 в витаминизированных подкормках и кормах./ Е. В. Михеева, Л. С. Анисимова // Материалы 6 конференции « Аналитика Сибири и Дальнего Востока» г.Новосибирс.-2000.-с.367.
6. Химические методы в количественном анализе
лекарственных средств: Методическое указание для студентов V курса по «Контроль качества лекарственных средств»/ Государственный Университет Медицины и Фармации им. Н. Тестемицану.- Кишинэу.- 2008
7. ГОСТ 29138-91
8. Л.Н. Корсун, Г.Н. Баторова, Э.Т. Павлова/- Математическая обработка результатов химического эксперимента: учебное пособие для студентов химических, медицинских и биологических специальностей и направлений-Улан-Удэ.- 2011.-70 с.